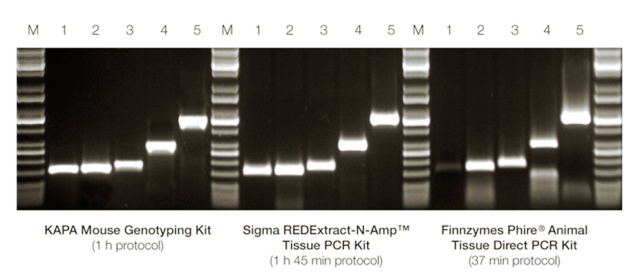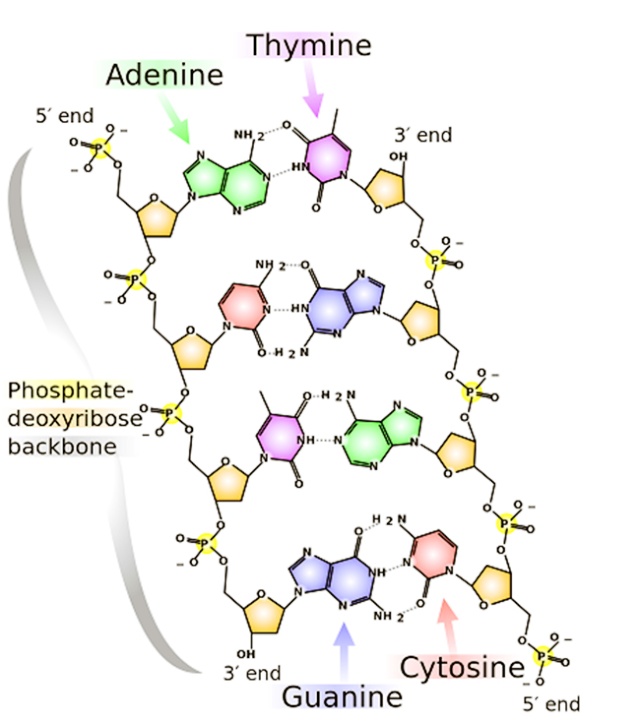
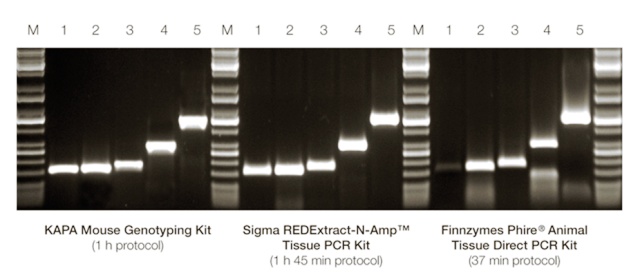
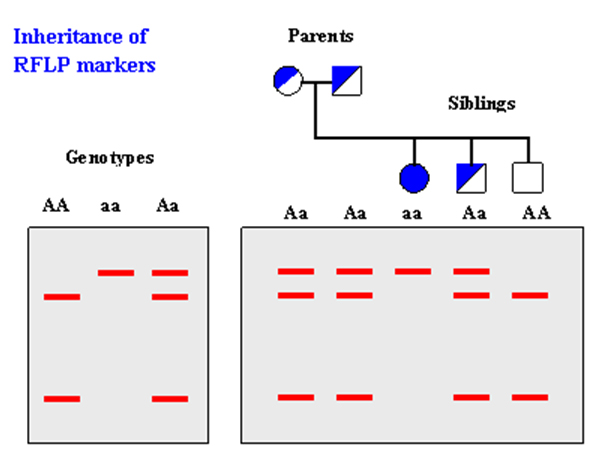
RFLPs (Restriction Fragment Length Polymorphism, полиморфизми в дължината на рестрикционните фрагменти). Те са базирани на нарязването на веригата на ДНК с известни рестрикционни ензими. Отделните фрагменти обикновенно се различават, поради точкови мутации, които създават/ нарушават мястото на срязване на ДНК или чрез делеции/инсерции могат да променят дължината на рестрикционния фрагмент. RFLPs са широко използвани като кодоминиращи маркери. За целта на този метод ДНК трябва да е с много високо качество. Въпреки това, този метод е много подходящ за филогенетични изследвания, въпреки че поради тежката методология на прилагането му да става все по–малко надежден.
RAPD (Random Amplified Polymorphic DNA, Случайно амплифицирани ДНК полиморфизми). Метода се базира на къси арбитражни праймери, които се свързват към дадено място в последователността на ДНК, без това да е предварително известно, на случаен принцип. Получените таргетни продукти се амплифицират и изследват. В случай на мутации, несъответствия между таргета и праймера, те ще се отразят на продукта. Това са доминантни маркери, като детекцията на полиморфизми е ограничено. По принцип, ако се използват за доминантни маркери за регистриране на хетерозиготност, необходими са поне още два кодоминантни.
Алозими и Изозими. Те са варианти на един и същ ензим. Разликата между тях е кодирана от различни алели на различни гени. Като продукт на генната дубликация, ако един вариант преминава в поколението, друг може да бъде загубен в резултат на мутация, следователно показва генетична вариация. Те често се използват като генетични маркери. Тези молекулярни маркери се използват в популационния генетичен анализ и се изследват с помощта на гел електрофореза, основана на ензимния електричен заряд. Тъй като много ензими са невариативни в популациите, използването на изозими и алозими като молекулярни маркери за генетични изследвания е ограничено.
SNPs / единични нуклеотидни полиморфизми, single nucleotide polymorphisms/. Те представляват промяна на една база в геномната последователност. Използват се главно като би – алелни, кодоминантни генетични маркери, тъй като показват полиморфизъм на ниво молекула ДНК. Генотипизирането със SNPs зависи от сравняването на локус – специфични последователности, които са на различни хромозоми. Тези маркери се нуждаят от локус специфично праймери и също са ограничени от гледна точка изследване на хетерозиготността.
Микросателити /Microsatellites /. Микросателитите са последователности от ДНК, които имат къси тандемни повтори. Тандемните повтори варират между индивидите, така че няма индивид с едни и същи повтори с друг. Микросателитите се използват в криминалистиката, диагностиката на болести, популационно генетични изследвания, в консервационната генетика и анализ на свързаност, поради техния полиморфизъм и обилното им присъствие в генома.
Приложение на микросателитните маркери
Генетичните изследвания, базирани на микросателити са потвърдени от проучвания на родствени връзки при аквакултури. В това проучване, индивид на морски охлюв Haliotis asinine е генотипизиран чрез анализ на полиморфни микросателити. 5 полиморфни локуса са изследвани за да се индентифицират родителите, получени от 3 различни кръстоски, което се постига от съчетаване на алели от един локус. 96% от родителството бе потвърдено.При поколение, получено при кръстоска на един родител, само един локус потвърждава наследството. Това изследване също така води до заключението, че микросателитите могат да служат като маркер при кръстосването и подобряване на програмите за успешно поддържане на генетичното разнообразие. Генетичната структура на домашните видове, която се цели от процеса на одомашняването, чрез генетични изследвания и анализи е направена в Тунис на зайци с помощта на микросателитни маркери. Детайлизирано се анализира генетичното разнообразия на тунизийските популации зайци. При това изследване 50 заешки популации от населени места от Тозур до Гафза са анализирани по 36 микросателитни маркери, въз основа на което са гентопизирани 294. Генетичното разнообразие между популациите показва, че 98,9% от цялото генетично разнообразие се изяснява с индивидуалната вариабилност с хетерозиготност варираща от 0,3 до 0,53. Този анализ не само помага за консервацията на популациите, но също така спомага идентификацията на локуси за икономически важни белези. При вълците са изследвани реколонизаторските процеси с помощта на популационната генетика. Вълците от Алпите и Апенините са генотипизирани с помощта на 12 микросателитни локуса и е изяснено, че вълците от Алпите показват ниско генетично разнообразие в сравнение с тези от Апенините. За да се докажат възможностите на микросателитните маркери са изследвани кучета. Кучетата нормално се различават по фенотипни белези, такива като размер, форма, окраска на козината и поведение. Въпреки тези различия, 28 породи кучета са анализирани за генетични вариации с помощта на 100 микросателитни маркери. Получените породи – специфични алелни честоти са използвани за интерпретация на генетичната дистанция между породите. Получените резултати също показват, че хетерозиготността намалява когато популацията намалява размера си.
Когато микросателитните маркери присъстват в половите хромозоми, те също така се използват за определяне на пола. Консистенцията на маркерите за определяне на Х и У – хромозомите, дори и в полово незрели индивиди, води до надеждността на микросателитните маркери при определяне на пола.
Определяне на пола
Фундаментален процес при повечето видове е свързан с половия фенотип, който определя бъдещето на индивида от ембрионалния период. Механизма на половата детерминация води до развитието на ембриона по два различни пътя: на женски и мъжкия фенотип. Идентификацията на пола е много важен критерий в еволюцията, природозащитна цел, пренаталната диагностика, криминалистиката, популационната генетика и също така при изследвания на застрашени от изчезване видове. Половото определяне е разделено на две големи категории: определяне на пола, зависещо от околната среда (ESD) и генетично определяне на пола (GSD). При първата категория, пола се определя от външни сигнали след оплождането, което означава, че пола в който зиготата диференцира не зависи от генетичната хромозомна композиция. При бозайниците определянето на пола главно зависи от хромозомната конституция на гаметите. Пола се определя от половите хромозоми, като ХХ определя женски, а ХУ мъжки индивид. В генома на бозайниците, У хромозомата носи определен набор от гени, които определят бащинството. Присъствието на SRY(sex determination gene, ген за полово детерминиране) на късото рамо на У хромозомите позволява определянето на пола. У – хромозомните специфични единични нуклеотидни полиморфизми SNPs имат ниско мутационно ниво и се използват У – специфични микросателити. Sry гена също се използва като директен филогенетичен маркер. Sry гена принадлежи към фамилията на Sox гени, които кодират група от транскрипционни фактори, свързващи се с малката бразда на двойната спирала ДНК. Тези Sox гени принадлежат към супер – фамилия от гени, характеризиращи се с хомологни последователности, наречени високо подвижна група / high mobility group HMG box/. Известни са повече от 20 Sox гени при бозайниците, въпреки че някой от тях нямат отношение за половата детерминация. Sox9 гена е установен, че се включва в определянето на пола, като неговата експресия е специфична за мъжките гонади на птици и бозайници и няма експресия при женските. Sox гените се регулират от Sry гена.
Цинк фингър домейни /Zinc finger domains/.ZFY е ген за цинк – фингър протеин кодиран в У – хромозомата, ZFX съответно в Х – хромозомата. В Япония е експериментирано определянето на пола при мармозетки на основа на тези гени, с помощта на PCR на полиморфизми в дължината на рестрикционните фрагменти (RFLP).След като са получени определени фрагменти и след това са нарязани с определени ензими, са открити различни ивици при гелната електрофореза, характеризиращи двата пола.
Амелогенин. Амелогенина е главен протеин, който формира външния емайлов слой на зъбите. AMELX/AMELY гените са хомологни последователности, които се намират в половите хромозоми на бозайниците. Предимствата да се използва тази техника е тази, че амплификацията на двата амилогенина AMELX/AMELY хоомлогни последователности може да се направи в една реакция. Такива изследвания са направени с комерсиална цел при кози. Първо са клонирани и определени интронните последователностти на AMELX/AMELY гените на козите от мъжки и от женски индивиди / пробата се взима, като тъкан от ушите/. Резултатите базирани на на PCR на полиморфизми в дължината на рестрикционните фрагменти (RFLP) и Southern blot хибридизация, показват, че в AMELY гена има повече делеции/инсерции, в сравнение с AMELX гена и също така че intron 5 има само 48% сходност с този на AMELX гена. След това при амплификацията на фрагменти от двете полови хромозоми изолирани на агарозен гел с PCR, използвайки полово – специфични праймери, са диференцирали пола на етап бластомер / ранно ембрионално развитие/. Този метод е широко използван, поради това че за разлика от детекцията чрез SRY gene, тук лесно се избягва проблема със замърсяването на пробата и грешен резултат. Предпочита се и пред ZFY/ZFX генна детекция на пола, поради своята чувствителност, акуратност, надеждност и приложимост и дори заради това, че е приложим дори и при 0.5ng изолирана начална/ матрична/ ДНК.
Предимства на микросателитите
Най-важното предимство на използването на микросателитите за различни изследвания е това, че те се нуждаят от малко количество матрична ДНК (10-100ng). Наличието на микросателитите в геномната ДНК и тяхната случайност в разпределението им е допълнително позитивен критерий. Друго полезно качество е значителното им ниво на полиморфизъм. Профила на ивиците може да бъде интерпретиран от гледна точка на локуси и алелни кодоминантни маркери. Големината на алелите може да бъде определена с голяма степен на точност. Микросателитите са доста подходящи за използване на мултиплексен PCR. Те се използват в редица приложения като криминалистиката, диагностиката и определянето на човешки болести, консервационната биология и др. Процеса може да бъде напълно автоматизиран.
Дизайн на микросателитни маркери/ праймери
С помощта на PRIMER3 софтуер може да се направи дизайн на микросателитни маркери и респективно праймери за тях, за конкретния вид, на който предстои анализ. Може също така да се използва MULTIPLX program за да се групират праймери за мултиплексен PCR. Основната цел на добрите праймери е да се получи ефикасна и достатъчна амплификация. Качеството на праймерите е пропорционално на успеха на амплификацията. Дължината на праймерите е свързана със спецификата на амплификацията.
Най-чести техники за генотипизиране
Генотипизирането може да бъде постигнато с помощта на много техники. RFLPs (Restriction Fragment Length Polymorphism, полиморфизми в дължината на рестрикционните фрагменти); AFLPs (Amplification Fragment Length Polymorphism, полиморфизми по дължина на амплифицираните фрагменти) ; RAPD (Random Amplified Polymorphic DNA, Случайно амплифицирани ДНК полиморфизми); SNPs / единични нуклеотидни полиморфизми, single nucleotide polymorphisms/ и полимеразна верижна реакция, polymerase chain reaction (PCR). Това са само някои от най-успешните и ефективни гехники, използвани за генериране на голям брой анонимни ДНК маркери за животни и растения.
Мултиплексен PCR е много успешен и широко използван похват на генотипизиране. При него е възможна амплификацията на два и повече продукта в една реакция. Амплифицират се много региони от една матрична ДНК или се използват няколко матрични ДНК – и повече от един набор праймери в една реакция. Използва се с цел качествен генно – експресионен анализ, криминалистиката, диагностичните лаборатории и др, на еукариотни и прокариотни организми. PCR с флуоресцентно белязани праймери може да генотипизира животинска популация, носеща нормални и мутантни гени. (Qiagen Multiplex PCR handbook, October 2010).
Приложение на мултиплексния PCR
- При животни/човека: Анализ на сателитна ДНК, генотипизиране на трангенни животни, анализ на свързаността, детекция на патогени, определяне на пола, детекция на мутации и качествен и количествен анализ на генна експресия.
- При растения: ГМО анализ, генотипизиране на трангенни растения, анализ на свързаността, детекция на патогени, определяне на пола, детекция на мутации и качествен и количествен анализ на генна
- При бактериите/вирусите: Хигиенен анализ, диагностика/патогенна детекция и качествен и количествен анализ на генната експресия.
PCR Инхибитори
Много учени са изправени пред предизвикателствата на успешната PCR амплификация. Инхибиторите взаимодействат или директно с матричната ДНК или с ДНК полимеразата, като или намаляват количеството на продукта или напълно стопират реакцията. Магнезия, който е критичен кофактор на ДНК полимеразата е обичайна мишена на тези инхибитори. Те се свързват с магнезия или намаляват концентрацията му и така инхибират PCR. Обичайно тези инхибитори се намират в кръвта, дамаски, тъканните проби, почвени източници в резултат на излишък на калиев хлорид, натриев хлорид и други соли. Също така ги има в присъствието на изо – детергенти, фенол, етанол и други алкохоли.
16 – капиларен 3130 xl генетичен анализатор; 16-capillary 3130xl Genetic Analyzer (Applied Biosystems)
Applied Biosystems имат дългогодишен опит в доставяне на инструменти, реагенти и софтуер за био – научните департаменти. Традицията в създаването и въвеждането на иновации в областта на генетичните изследвания бе продължена с интродуцирането на 3130xl Genetic Analyzers. 16 – капиларния 3130 xl генетичен анализатор е доказал своето предимство и ползите от техниката на Applied Biosystems с подсигуряването на високо качество на данните, бързина, автоматизация и надеждност при секвениране, ре – секвениране, генотипизиране и фрагментен анализ. Тази система вклъчва също много полезни софтуери като Sequencing analysis software / Софтуер за секвенционен анализ/, SeqScape® и Gene Mapper. Sequencing analysis осигурява, анализира и показва секвенционните данни. SeqScape® се използва за детекция на мутации и профилиране. GeneMapper е идеален инструмент обхващаш множество функции за генотипизиране, алелен анализ, определяне големината на фрагментите и SNP анализ. Quality Values (QV) е предназначена за анализ на фрагментите и всеки един от тях лесно може да бъде идентифициран. Приложения включващи микросателитен анализ / на диплоиди и полиплоиди/, картиране, SNP анализ, AFLP, флуоресцент свързан количествен анализ, включващ загуба на хетерозиготност и конформационно определяне.
Данните от генотипизирането се използват за анализ и изучаване на геномното картиране, популационната генетика. Генотипизирането с неутрални маркери позволява определянето на мутации, които са пропорционални на полиморфизма на неутралните маркери. Степента на мутации спомага за оценка на генетичната дистанция и също се наблюдава при предаването на алелите от родителите на поколението, като данните се използват за анализ на свързаността и родословието на индивидите. Генотипизирането на основа на микросателитни маркери също така се използва при идентификация на бащинство, криминалистика и в популационната генетика.
Автор: Димитра Лефтерова
Източник: nauka.bg